
Kweekervaringen met Hynobius dunni
Henk Wallays, 2002. Kweekervaringen met Hynobius dunni
pag. 11 -14; uit: BOUWMAN, A. S. BOGAERTS (samenstelling en redactie),
2002. Salamanders. Jubileumbundel. Uitgave: Salamandervereniging.
ISBN 90-9016241-0.
Kenmerken
De vaal geelgroene kleur van deze salamanders doet denken aan H. nebulosus. H. dunni wordt echter groter: de totale lengte van volwassen dieren varieert van 10 tot 16,5 cm en de kop-romp lengte ligt tussen de 6 tot 8 cm. Het lichaam is gewoonlijk bezet met vele ronde zwarte vlekken. Ik heb de indruk dat bij het ouder worden deze vlekken verdwijnen. H. dunni bezit – in tegenstelling tot H. nebulosus – geen gele lijn op de staart. In de voortplantingstijd kleurt de staart helemaal geel. Doorgaans bezit H. dunni 12, maar soms 11 ribgleuven. Volgens literatuur kan H. dunni tot 16 jaar oud worden. Mijn adulte groep is momenteel 7 jaar en ik hoop dan ook nog enkele jaren plezier te kunnen beleven aan deze salamanders.
Verspreiding
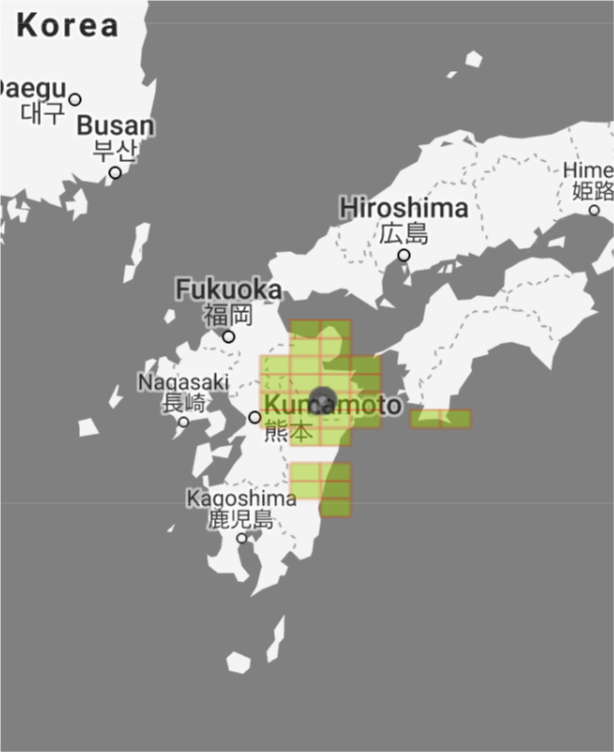
Hynobius dunni komt voor in Japan op de eilanden Sjikokoe (in de streek Kouchi-ken) en Kioesjoe (in de streken Ohita-ken, Miyazaki-ken, Kumamoto-ken). Daar wordt deze salamander ‘Ohita sansyou-uo’ genoemd.
Ecologische gegevens
H. dunni is bekend uit laag- en heuvelland en leeft in secundaire bossen of bamboewouden. De voortplanting gebeurt in vijvers, moerassen, poeltjes en waterstroompjes langs rijstvelden. Bij voorkeur worden die watertjes gebruikt waarin dode bladeren en takjes aanwezig zijn. De voortplantingsperiode start in december en loopt tot het einde van april, waarbij de piek zich in februari voordoet. Buiten deze periode leven de salamanders op land onder stenen en tussen bladafval (SENGOKU, 1979). Door de vernietiging van hun broedplaatsen, voor de constructie van woningen, wordt deze soort langzamerhand bedreigd. Eind 1999 kwamen deze salamanders dan ook op de Japanse rode lijst terecht en kregen als status ‘kwetsbaar’ (Ikeda & Kawamura, pers. mededeling). Daarom werd in dat zelfde jaar ook besloten tot het bijhouden van een stamboek om deze soort voor de terrariumhouderij te behouden.
Inrichting van de bak
De salamanders zijn gehuisvest in een aqua-terrarium, waarvan de afmetingen van de bodem 140x 50 cm zijn. De bodembedekking bestaat uit gewassen Rijnzand. De waterhoogte ligt op 10 tot 12 cm. Tweederde van de bak bestaat uit een eiland van op elkaar gestapelde snelbouwstenen. Deze worden gebruikt voor isolatiedoeleinden en vertonen vele lange luchtopeningen. Door de capillaire werking van deze stenen wordt het water opgezogen tot in de bovenste regionen. Op deze stenen ligt een laag spaghnum/mos van ongeveer 10 cm dik. Mede door de vochtigheid van de natte stenen en condensatie kan dit groene tapijt zich voorzien van het nodige vocht. Deze dikke plantenlaag speelt tevens een rol als temperatuurbuffer. Op het mos liggen her en der stukken boomschors. Voedseldieren blijken zich in deze opzet behoorlijk lang te kunnen handhaven. Pissebedden plantten zich zelfs voort in de bak. De bak is geplaatst in een geïsoleerd tuinhuis. Een plexiglazen plaat in het dak van het tuinhuis zorgt voor het nodige en natuurlijke licht. Er wordt geen kunstmatig licht gegeven. Gedurende de winter kan de temperaturen dalen tot rond het vriespunt.
Aangezien de eizakjes van H. dunni aan takken worden afgezet in het water is het raadzaam te zorgen voor voldoende (dode !) takken in de waterpartij. Deze worden zo gepositioneerd dat ze gedeeltelijk parallel lopen met het wateroppervlak. De dikte is belangrijk aangezien deze het gewicht van meerdere salamanders moet kunnen dragen. Voor zijn studie omtrent de voortplanting van de robuuste H. retardatus vermeldt SATO (1992) een dikte tot 1,3 cm. Ook bij mij werd zowel door H. dunni als H. retardatus een dergelijke dikke tak uitgekozen, die door vrouwtjes worden gebruikt voor de eiafzet en een rol speelt bij het (eventuele) territoriale gedrag van mannetjes.
Gedrag in gevangenschap

H. dunni leeft vrij verscholen en is pas actief bij temperaturen onder 14 °C, waardoor activiteit voornamelijk in de lente en herfst plaats vind. In deze perioden vindt men de salamanders tijdens de avondschemering in de waterpartij. Tijdens de zomer en winter verblijven ze op zeer vochtige plaatsen op het landgedeelte. De salamanders houden zich vaak op in de eerder aangehaalde isolatieholten. Bij voorkeur in die openingen die deels in het water steken. Mijn inziens doet zich buiten de voortplantingstijd een omgekeerde relatie voor tussen leeftijd en de aanwezigheid in het water: jongere dieren zijn buiten de voortplantingsperiode regelmatig in het water te zien en volwassen dieren verblijven in deze periode vooral op het land.
Voedsel
H. dunni is in zijn voedsel niet kieskeurig. Het zijn gretige afnemers van regenwormen, vliegenmaden, buffalowormen, rode muggenlarven, pissebedden, duizendpoten e.a. insecten Het veelvuldig voeren tijdens de rustperiode, leidt al snel tot ‘ronde’ dieren. Ze eten, doch verbruiken wegens hun traagheid, bijna niets. In tegenstelling met veel andere salamanders worden naaktslakken niet gegeten. Dit feit doet zich ook voor bij andere Hynobius soorten die ik verzorg.
Voortplanting
MASHIBA (1969) meldt dat de eiafzet bij 9°C plaatsvindt Zijn grafieken tonen aan dat de afzet gebeurt bij die dalende temperaturen die volgen op een voorgaande warmtepiek. De lengte van de eizakken is 15 tot 30 cm. De bij mij afgezette eizakken waren kleiner. Een legsel bevat circa 80 tot 140 eitjes. Zoals ook bij andere Hynobius soorten trekken de mannetjes het eerst het water in, dit gebeurde bij mij bij temperaturen rond de 5°C.
Op 18 maart 2001, een zonnige dag, kon ik enkele waarnemingen verrichten aan het paargedrag van H. dunni. Omstreeks 13.00 u. noteerden ik drie zeer actieve mannetjes. De mannetjes hadden een lichte vlek op de keel, die bij het op één na grootste dier feller van kleur was als bij de beide andere mannetjes. De mannetjes bewogen zich over de bodem en hadden vooral veel oog voor de takkenpartij in het water. Dit noem ik de wandelfase. Van tijd tot tijd klommen de mannetjes tussen de takken en hadden hierbij de meeste interesse voor die takken die zich net onder het wateroppervlak bevonden. Dit noem ik de klauterfase. In tegenstelling met de andere mannetjes klauterde het dier met de meest duidelijke vlek op de keel niet enkel over de takken, maar zocht met regelmatige tussenpauzen steeds een zelfde tak op. Deze liep op het einde parallel met het wateroppervlak.

THORN (1991) meldt dat H. retardatus voor het afzetten van het legsel ook een voorkeur vertoont voor een horizontaal hangende worteltak. Het mannetje haakte zich soms met een voor- en achterpoot lateraal vast aan de tak en zwaaide hierbij vrij rustig met zijn staart heen en weer. Door de ligging van de tak kwam de bovenzijde van de heen en weer bewegende staart soms boven het water uit, waardoor het water in beweging kwam. Het moedwillig storen van het stille wateroppervlak door het staartzwaaien is ook van andere Hynobius soorten gemeld, zoals van H. nigrescens (USUDA, 1995). Tijdens het staart waaieren richtte het mannetje zijn keel neerwaarts en blies als het ware zijn verbrede keel op. Hierdoor werd de lichte keelvlek van de bodem duidelijker zichtbaar. Deze fase noem ik de lokfase.
Als hierop van vrouwelijke zijde geen reactie kwam liet het mannetje zich terug van de tak glijden om te vervallen in de wandelfase of wreef hij met zijn cloaca over de tak op de plaats waar hij het lokgedrag had uitgevoerd. Dit gedrag noem ik de markeerfase. Indien op de markeerfase geen vrouwtje reageerden, verviel het dier terug in de wandelfase. De volledige cyclus (wandel-, klauter-, lok- en markeerfase) werd een paar keer na elkaar herhaald zonder dat er een vrouwtje op reageerden.
Ongeveer om de 10 minuten verviel het mannetje terug in de lokfase. Als de mannetjes een vrouwtje waarnamen trok dit duidelijk hun belangstelling. Het vrouwtje werd dan veelvuldig besnuffeld. Als een vrouwtje dat eitjes moet afzetten ook interesse vertoonde voor de takkenpartij en hierop klauterde (wegens het door de eitjes opgezwollen lichaam kunnen deze vrouwtjes nauwelijks nog zwemmen) verhoogde de interesse van de mannetjes en kwamen deze dichterbij. De mannen gedroegen zich op dat moment behoorlijk zenuwachtig en duwden meermalen het vrouwtje van de takkenpartij af.
Op een bepaald moment ging het mannetje weer over tot de lokfase. Het mannetje was nog maar net begonnen met het staartzwaaien toen een vrouwtje hierop met een onwaarschijnlijk grote snelheid reageerde. Ze kwam vanonder de stenen rechtstreeks af op de takkenpartij en klauterde tot bij het mannetje. Quasi onopgemerkt waren ook de andere mannetjes dichterbij gekomen en in hun daaropvolgende hitsige inmenging werd het vrouwtje van de takken geduwd.
Tijdens deze actieve fase zag ik ook een man die met een opengesperde muil een andere mannetje bedreigde. Dit agressief gedrag werd slechts één maal geobserveerd. Helaas moest ik mijn waarnemingen op dat moment staken en vond ik 3 uur later een vers afgezet (nog vrij verfrommelde) legsel op de voormelde gemarkeerde plaats. In de week die hierop volgde werden nog twee legsels ontdekt die in de directe omgeving van het eerste legsel waren afgezet.
Na de eiafzet kon ik steeds één man terugvinden in de directe omgeving van het legsel. Het is momenteel (nog) niet duidelijk of de interesse van dit mannetje gericht was op de afzetplaats of op het broedsel.
Larven

Bij temperaturen van 8 tot 10°C komen de larven na 39 dagen uit het ei. De pas uit het ei gekomen larven, meten doorgaans 14 mm. Uit een legsel met minder eieren werden uitzonderlijk grote larven van 17 mm opgemeten. Als typische poellarven bezitten de larven na uitkomen goed ontwikkelde balanceerders, grote kieuwen aan beide zijden van de kop en hoge vinzomen. Al vanaf het uitkomen vertonen de larven de typische zwarte staart tip. Het lijkt erop dat als er minder eitjes in een eizak steken dit ten goede komt van de grootte van de larven. Grotere larven kunnen grotere prooien grijpen en groeien daardoor sneller. De larven leven hoofdzakelijk op de bodem waar ze ook naar voedsel zoeken. Volgens de literatuur voederen ze zich voornamelijk met in het water voorkomende insectenlarven en beekvlokreeftjes (Gammarus sp.). Bij hoge dichtheden kan kannibalisme optreden.
Mijn larven bleken een ongelooflijke eetlust aan de dag te kunnen leggen, dit ging tevens gepaard met een ongewone agressiviteit. Larven die amper 4 cm waren slaagden zonder problemen in het opschrokken van meerdere vliegenmaden van ongeveer 1 cm, welke ze ook zonder problemen verteerden. Deze vraatzucht stelt bijzonder hoge eisen aan de voedselhoeveelheid. Aangezien het vele afval wat de larven produceren, moet de kweekbak regelmatig schoongemaakt worden.
De pas uit het ei gekomen larven werden gevoederd met watervlooien (Daphnia) en Tubifex. De larfjes hadden vooral voor Tubifex een duidelijke voorkeur. Later werden ook rode muggenlarven en enchytreën gevoerd. In de natuur lijkt predatie op kikkerlarven zeker geen onwaarschijnlijkheid. Als de larven eenmaal zo’n 3 cm groot zijn aarzelen de agressieve steeds hongerige larven niet om hun prooien door de hele bak achterna te zwemmen.
Het uitkomen van de eieren leverde geen problemen op. In 1999 kwam ruim 80% van de eitjes uit. Slechts enkele eieren gingen ten onder aan schimmel (Saprolengia sp.). Daarna dook echter een probleem op. Een groot aantal larven kwam boven drijven met een‘gasbuik’ syndroom. Dit probleem hield aan tot dat de larven een lengte hadden bereikt van 3 cm. Dit bleek in bijna alle gevallen dodelijk te zijn. Doorprikken noch frequente waterverversing leverde geen positief resultaat op. Mogelijk was dit te wijten aan de gehanteerde (hogere) temperaturen waardoor het metabolisme op een te hoog niveau uitkwam. Een andere mogelijkheid kon een infectie en of een vergiftiging vanuit het aangekochte voedsel zijn (rode muggenlarven). Frappant was wel dat de overlevende larven zonder verdere problemen werden opgekweekt met hetzelfde voedsel.
Teneinde de invloed van de temperatuur of voeding en sterfte te lokaliseren werden het jaar daarop 26 larven opgekweekt bij temperaturen 13 tot 15°C (groep A). De overige larven werden opgekweekt bij temperaturen van 7 tot 9°C in een tuinhuis (groep B). Om de invloed van het bedorven voedsel te weren werden beide groepen enkel met watervlooien en enchytreën gevoederd. De larven van groep A bleken agressieve eters te zijn. In 8 dagen tijd groeiden ze uit tot 20–22 mm, doch plots startten er opnieuw problemen. De larven gingen massaal ten onder aan een schimmelinfectie. Slechts 8 larven overleefde dit.

Om geen verdere onnodige sterfte te creëren werden ze uiteindelijk terug in het koude tuinhuis bij de overige larven gezet. Ze bleven wel in hun aparte bak. In het koudere water zag je de dieren in groep B nauwelijks bewegen. Toch groeiden ze in diezelfde periode aan tot 16 a 17 mm, zonder sterfte. Maar ook hier manifesteerde de dodelijk schimmelinfectie zich: slechts 3 larven (van de 120) overleefden deze fase. De snelheid waarmee deze infectie aansloeg was bijzonder snel: de ene dag was ogenschijnlijk niets aan de hand, de andere dag lagen er dode, door schimmel overwoekerden lijkjes op de bodem.
Op basis van deze bevindingen lijkt het dat voeding en temperatuur uit te sluiten zijn als oorzaak voor de sterfte, waarschijnlijk dat door de waterkwaliteit de problemen werden veroorzaakt. Ondanks dat (doordat ?) ik de larven telkens in een nieuw opgezette kweekbak had gezet. In het daarop volgende jaar werd daarom een andere strategie toegepast: de eizakken werden ongemoeid gelaten in de moederbak, een week na uitkomen werden de ouderdieren uit de bak verwijderd.
Vanaf dat moment werd bewust geen waterverversing meer toegepast. Dit bleek de sleutel tot een succesrijke opkweek te zijn. Twee weken na uitkomen begon ik met het gedeeltelijk wegvangen van een deel van de jonge larven, dit om de hoge concentraties te drukken. Door het uitgroeien van de larven moest dit wel om de week tot 2 weken herhaald worden. Op het einde van de larve fase waren ongeveer 12 verschillende middelgrote aquaria met deze larven gevuld.
In de 4 jaren dat ik met deze salamanders kweek, werd bijna geen kannibalisme waargenomen. Wel ontwikkelden sommige larven een veel grotere kop. Enkel in 1999 noteerden ik 2 gevallen van kannibalisme. In tegenstelling met H.tokyoensis (KUSANO, 1985) werden de aangevallen larven niet bij de kop gegrepen, maar aan de staart. Daarom denk ik dat het hier eerder om een ‘ongeluk’ ging dan een beredeneerd kannibalisme.
Juveniele landfase
In de natuur metamorfoseren de larven in augustus of september. Reeds enige tijd voor de metamorfose kan men de zo typerende Hynobius kop herkennen: een korte kop waarbij de ogen heel dicht tegen de snuit liggen. Als eerste stap tot de metamorfose kan men de ‘ribgleuven’ waarnemen, kort daarop verdwijnen de vinzomen, als laatste verdwijnen de kieuwen. Sommige dieren gaan aan land met nog zichtbare kieuwstompjes. De afmeting bij metamorfose zijn van 5 tot 5,7 cm. In 2001 traden er grote lengteverschillen op tussen de larven doordat de dichtheden per bak verschilden. In bakken met hoge dichtheden metamorfoseerden de dieren bij totale lengtes van 4,6 tot 4,8 cm, terwijl buiten in een zwembadje (met een lage dichtheid van larven) neoteen uitziende jonge dieren werden terugvonden van 7,5 en 7,7 cm. De metamorfose was bij deze laatste wel al ten dele ingezet: ze vertoonden enkel nog kieuwresten en het adulte kleurpatroon. Bij het schrijven van dit artikel waren nog niet alle dieren gemetamorfoseerd. In totaal werden er 177 juveniele en 102 grote larven geteld.

Onder de juveniele ontwikkelen zich twee verschillende kleurpatronen. Een groep van kleine zwarte dieren en een groep van grotere geelbruine dieren. Deze laatste zijn tevens voorzien van zwarte ronde stippen en vertonen dus reeds het volwassen kleurenpatroon. De beide vormen beschikken over de voor jonge dieren typische wit/blauwe iridiscerende puntjes. Enkele maanden later kleurden de donkere dieren ook bij. De opkweek van de juveniele gebeurt in een verkleinde kopie van de bak van de volwassen dieren. Voor een gedetailleerde omschrijving hiervan zie WALLAYS (2000). Doordat de kweekbak is afgesloten met een glasplaat en hierop een TL lamp ligt, lopen de temperaturen tijdens de zomermaanden soms op tot 27°C. Dit leverde tot op heden geen problemen op, vermoedelijk mede door de vele (koelere) schuilplaatsen. Jongen van H. dunni blijken, na mijn ervaringen, met uitzondering van de eerste larve fase (< 3 cm), vrij tolerante tot zeer sterke dieren te zijn, ten opzichte van de temperatuur en waterkwaliteit. De groeicurve van de juveniele kan sterk versneld worden door ze tijdens de winter bij temperaturen van 14°C tot 20°C dagelijks te voederen.
In de herfst van 2000 maten de jongen van ’99 gemiddeld 10,4 cm (grootste 12,5, kleinste 8,1 cm). De nakweek van 2000 was gemiddeld 6,8 cm (grootste 7,6 , kleinste 5,8 cm). Bij beide groepen was de verhouding van de kopbreedte versus totale lengte 11,1%.
Stamboek
Op basis van een kweekgroep van 10 dieren werden in de periode 1998 – 2000 een 50 tal dieren opgekweekt. Door het oplossen van de problemen in de eerste fase van de larven (als ze kleiner zijn dan 3 cm) konden in 2001 uiteindelijk 279 bijkomende dieren opgekweekt worden. Mijns inziens staat niets meer in de weg om deze uiterst sterke en gemakkelijk te houden salamander verder te verspreiden. Hierbij is voor de ernstige liefhebber ook heel wat ruimte tot nieuwe en interessante observaties (o.a. voortplantingsgedrag, relatie tussen wintertemperatuur versus kweek, groeicurves, etc.).
Nawoord
Ik wens Jun Ikeda en Ad Bouwman beide uitdrukkelijk te bedanken voor de door hen aangeleverde hulp en informatie, die hierdoor het artikel mede interessant maakt.
Summary
A group of 8 Hynobius dunni from Beppu-shi, Japan are kept in a tank of 140 x 50 cm in an unheated, frost free garden shed, with natural lighting. The water part (10-12 cm high) holds a large land-area (2/3rd of the surface) of broken stones with large packs of moss. The contact of the moss and evaporation guarantees both humidity and cool temperatures. Food mainly consisted out of worms, buffalo-worms and maggots. Slugs were not eaten. During reproduction period (from February till March), dead branches are introduced in the water part for egg-deposition. Frequent water-changes during the spring stimulate breeding behaviour. Males start becoming activity from 5°C on. Their mating strategy was observed and divided up in 4 stages : the walking phase, where males are wandering across the floor, the climbing phase when males are crawling on and off the twigs, the attraction phase, when a male hangs itself on a twig and fans it’s tail in order to attract females and finally the marking phase when a male rubs his cloaca on the branch. The 3 egg sacs were al deposited on or in the direct environment of this marking place. After major (fungal & gas belly) problems raising the larvae of 1999 and 2000 (in fresh installed containers), the eggs of the 2001 breeding were left in the tank. At temperatures between 8-10 °C the eggs hatched after 39 days. To avoid predation, the parents were removed after the eggs were deposit. Fresh hatched larvae usually measured 14 mm. In order to break the high densities groups of larvae were set other (aged) tanks that starting from the 2nd week and as they grew. The ground dwelling, voracious larvae were fed daphnia, tubifex (preferred food), bloodworms and maggots. Only 2 cases of cannibalism occurred in 4 years of breeding. According to densities and temperatures, juveniles metamorphosed at lengths ranging from 4,6 to 7,7 cm, the usual length being 5,5 to 5,7 cm. The juveniles proved very hardy and even tolerated temperatures up to 27°C. The were raised in moss filled containers. In the fall of 2000 the average offspring of ’99 measured 10,4 cm (8,5 – 12,5 cm). In 2001 a total of 279 animals were raised. The writer has set up a studbook for this species.
Literatuur
KUSANO, T., 1985. Size related cannibalism among larval Hynobius nebulosus. Copeia (2): 472-476.
MASHIBA, S., 1969. Ecology of Hynobius dunni – chiefly its breeding activity. Saishu to Shiiku ( Collecting & Breeding) 31(5): 122-135 (Japans).
SATO, T., 1992. Reproductive behavior in the Japanese salamander Hynobius retardatus. Japanese Journal of Herpetology 14(4): 184-190.
SENGOKU (ED.), 1979. Amphibians and Reptiles in color (Japans).
THORN, R..,1991. Observations et notes sur diverses espèces de Salamandres (Amphibia, Caudata). Bull.Soc.Nat.luxemb. (92): 79-83.
USUDA, H., 1995. Waving behavior and its effect on the reproductive behavior of Hynobius nigrescens. Japanese Journal of Herpetology 16(1): 19-24.
WALLAYS, H., 2000. Raising metamorphosed juveniles, Indiana university Axolotl Newsletter 28: 10-17.
© Copyrights 2002 de Salamandervereniging, www.salamanders.nl.
De Salamandervereniging staat ingeschreven bij de Kamer van Koophandel, te Nijmegen, onder nummer 09126981.
Actueel
Veilige oversteek voor salamanders tijdens de voorjaarstrek
Elk voorjaar trekken niet alleen kikkers en padden, maar ook salamanders naar hun voortplantingswateren. Tijdens deze trek steken ze vaak…
Salamanders nog actief door zachte herfst
Het aanhoudend zachte weer zorgt ervoor dat veel salamanders hun winterslaap uitstellen. Vooral op vochtige avonden zijn ze nog te…
Japan ontdekt exemplaar van ’s werelds grootste bedreigde amfibie
Onderzoekers van de Kyoto Universiteit hebben recent de aanwezigheid van de Chinese reuzensalamander (Andrias davidianus), de grootste levende amfibie ter…


